 De un modo similar a los alcoholes los los ácidos carboxílicos presentan un comportamiento tanto ácido como básico.
De un modo similar a los alcoholes los los ácidos carboxílicos presentan un comportamiento tanto ácido como básico.
Comportamiento ácido
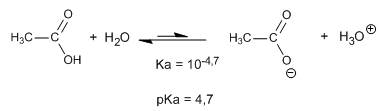
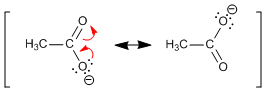
Comportamiento ácido: el hidrógeno del grupo hidroxilo de los ácidos carboxílicos presenta un pKa comprendido entre 4 y 5, valores relativamente bajos que tienen su explicación en la importante electronegatividad del grupo carbonilo al que está unido y a la estabilización por resonancia de la base conjugada.
Acidez y grupos electronegativos
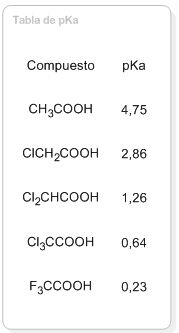
Los grupos electronegativos aumentan la acidez del los ácidos carboxílicos ya que roban carga por efecto inductivo, estabilizando la base conjugada (ion carboxilato). En la siguiente tabla puede observarse la disminución de pKa que se produce al introducir halógenos en la cadena carbonada, llegándose incluso a valores cercanos a cero.
| Compuesto | pKa |
| CH3COOH | 4,75 |
| ClCH2COOH | 2,86 |
| Cl2CHCOOH | 1,26 |
| Cl3CCOOH | 0,64 |
| F3CCOOH | 0,23 |
Comportamiento básico
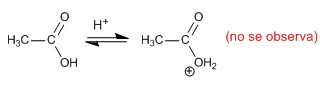
Comportamiento básico: la protonación del grupo ácido se produce sobre el oxígeno del grupo carbonilo ya que la especie obtenida se estabiliza por resonancia, deslocalizando la carga positiva sobre el grupo hidroxilo.
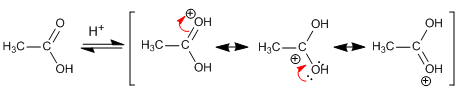
No se observa la protonación sobre el grupo hidroxilo, dada la imposibilidad de estabilización de la carga por resonancia.