 Diferencia de energía entre conformaciones
Diferencia de energía entre conformaciones
Las diversas conformaciones del etano no tienen la misma energía, esto se debe a la repulsión electrónica entre hidrógenos. Cuando vamos girando la molécula a partir de una conformación alternada, la distancia entre los átomos de hidrógenos de los respectivos grupos metilo empieza a disminuir, produciendo un aumento de la repulsión entre los pares de electrones enlazantes de los enlaces C-H. La energía potencial del sistema aumenta hasta llegar a la conformación eclipsada.
Diagrama de energía potencial del etano
Las diferencias de energía entre las distintas conformaciones pueden verse representando gráficamente la energía de cada conformación frente al ángulo girado. Como puede observarse en el diagrama del etano, las conformaciones eclipsadas son los máximos de energía y las alternadas los mínimos.
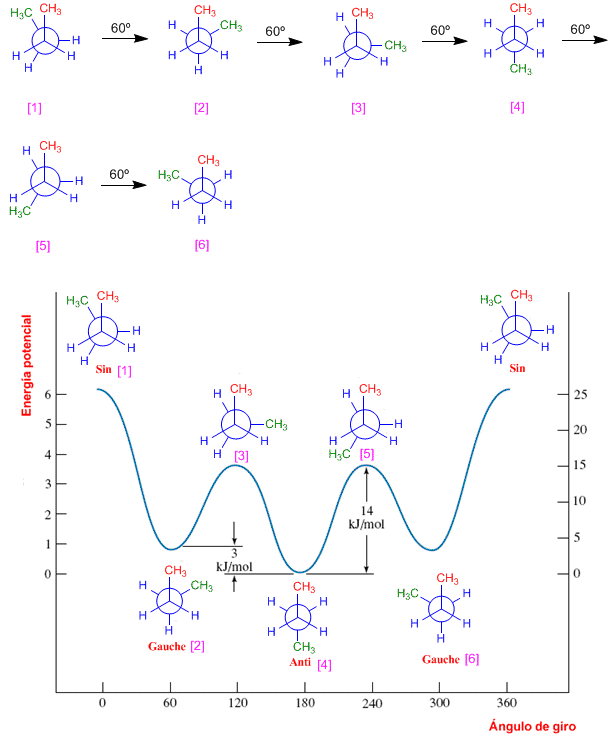
Para obtener el diagrama de energía potencial del etano partimos de la conformaciòn eclipsada y vamos realizando giros de 60º hasta recorrer los 360º.
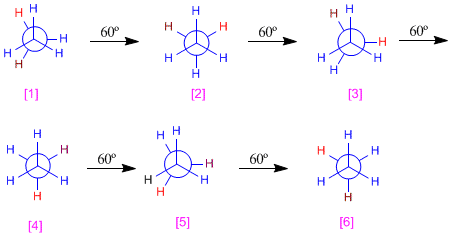
Clasificamos las distintas conformaciones según energía. Las alternadas [1], [3] y [5] tienen la misma energía, que llamaremos E1 (en el diagrama la tomaremos como cero). Las conformaciones [2], [4] y [6] tienen más energía debido a los eclipsamientos hidrógeno-hidrógeno. Estas conformaciones eclipsadas están unas 12 KJ/mol por encima de las alternadas.
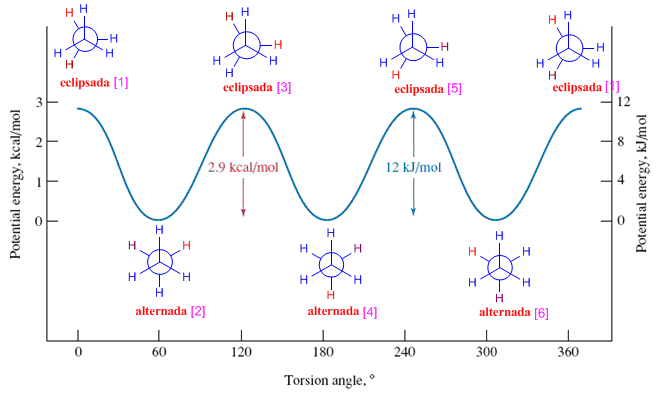
Diagrama de energía potencial del butano
En el diagrama del butano existen mas conformaciones que una alternada y una eclipsada. La conformación alternada que tiene los metilos lo más lejos posible uno del otro se llama anti [4] y es la más estable, al tener las mínimas repulsiones. La rotación del carbono de atrás 60º da lugar a una eclipsada [5] con dos interacciones metilo-hidrógeno, un nuevo giro da lugar a otra alternada llamada gauche [6]. Un tercer giro deja los metilos enfrentados (eclipsados) se denomina conformación sin [1] y es la de mayor energía potencial.