 Conformaciones del etano
Conformaciones del etano
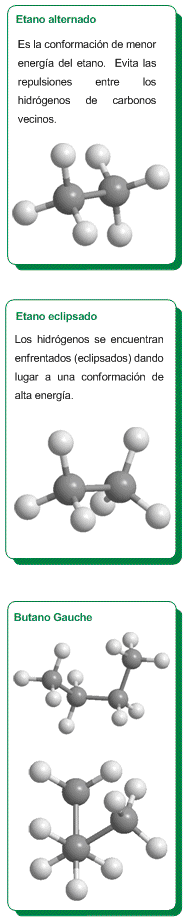
En el modelo molecular del etano representado a la derecha, podemos ver que los metilos pueden girar fácilmente uno respecto al otro. La energía necesaria para este giro, es de tan solo 3 kcal/mol. Se puede decir que hay rotación libre alrededor de los enlaces simples.
 Conformaciones alternada y eclipsada del etano
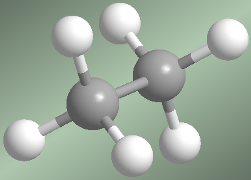
Conformaciones alternada y eclipsada del etano
Hay dos maneras de dibujar la molécula de etano: la conformación alternada y la eclipsada. En la conformación alternada cada átomo de hidrógeno del primer carbono se encuentra situado entre dos átomos de hidrógeno del segundo carbono, lo que evita repulsiones y hace que esta conformación sea de baja energía. En la conformación eclipsada todos los átomos de hidrógeno del primer carbono se hallan enfrentados a los del segundo. La rotación del metilo entorno al enlace C-C, permite el 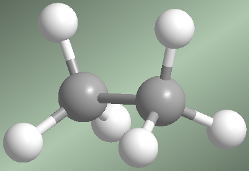 paso de la conformación alternada a la eclipsada y viceversa.
paso de la conformación alternada a la eclipsada y viceversa.
Las múltiples formas del etano creadas por rotación alrededor del enlace C-C son conformaciones y el estudio de las mismas se denomina análisis conformacional.
Isómeros conformacionales del butano
En el butano la rotación alrededor del enlace C2-C3 también genera conformaciones alternadas y eclipsadas, entre las que destacan: conformación sin, conformación anti y conformación gauche En estos modelos moleculares se representan las conformaciones anti, sin y gauche del butano.
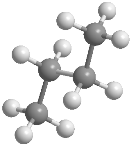
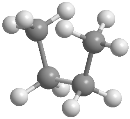
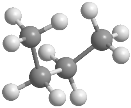
La conformación anti es la de mayor estabilidad del butano, los grupos metilo están alejados y no interaccionan. La conformación gauchees de menor estabilidad, en ella existe una interacción entre metilos que están situados a 60º, llamada interacción gauche.