En la síntesis de Skraup, la anilina [1] reacciona con carbonilos $\alpha,\beta$-insaturados en medio ácido, para formar 1,2-dihidroquinolinas [3], que mediante oxidación se transforman en quinolinas [4]. El carbonilo a,b-insaturado puede obtenerse por deshidratación del 1,2,3-propanotrio [2].
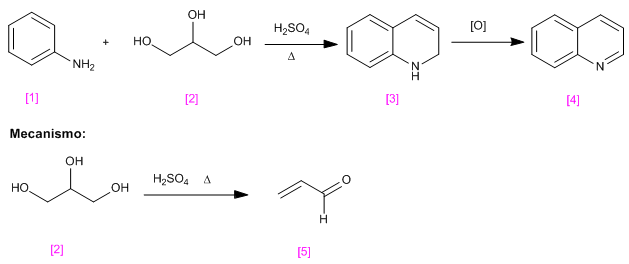
En esta síntesis partimos de 1,2,3-propanotriol [2] que se transforma en propenal [5] por tratamiento con ácido sulfúrico.
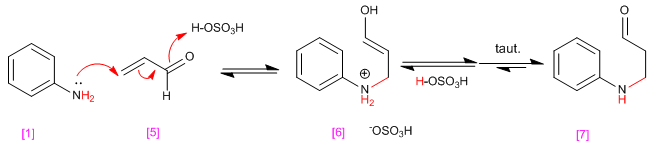
En la primera etapa del mecanismo se produce la adición de Michael entre la amina [1] y el a,b-insaturado [5] para formar un enol que genera un b-aminocarbonilo [7] después de perder un protón y de una tautomería cetoenol.
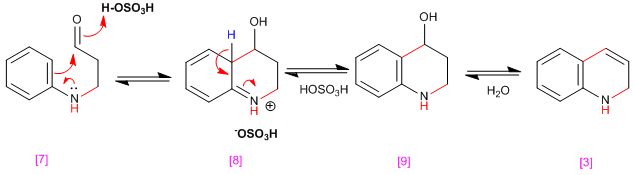
El compuesto [7] cicla por ataque del benceno, previa protonación del carbonilo, ayudado de la cesión del par no enlazante del nitrógeno formando el intermedio [8], que rearomatiza por pérdida de protón generando el compuesto [9]. La deshidratación del alcohol [9] produce 1,2-dihidroquinolina [3].