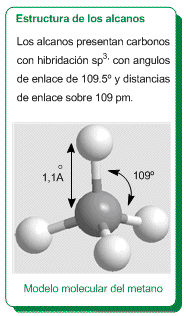
 Wechselwirkung durch London-Kräfte
Wechselwirkung durch London-Kräfte
Bei Alkanen steigen die Schmelzpunkte mit zunehmender molekularer Größe, eine größere Oberfläche führt zu einer stärkeren Anziehung aufgrund der London-Kräfte.
Siedepunkte bei Alkanen
Die Siedepunkte steigen ebenfalls mit dem Molekulargewicht, je schwerer ein Molekül ist, desto mehr Energie wird benötigt, um vom flüssigen in den gasförmigen Zustand überzugehen.
Lineare und verzweigte Alkane
Verzweigte Alkane haben kleinere Oberflächen als ihre linearen Isomere, was zu geringeren Anziehungskräften und damit zu niedrigeren Schmelz- und Siedepunkten führt.
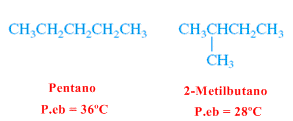
2-Methylbutan (verzweigtes Alkan) hat einen niedrigeren Siedepunkt als Pentan (lineares Alkan).
Wasserlöslichkeit
Alkane sind aufgrund ihrer fast null Polarisierbarkeit in Wasser unlöslich. Ihre Dichten liegen zwischen 0,6 und 0,8 g/ml, sodass sie auf Wasser schwimmen.