 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp.
Más información en www.foroquimico.com
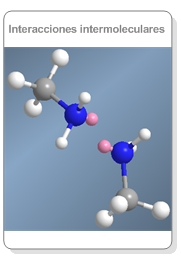 Estructura de las aminas
Estructura de las aminas
El nitrógeno de las aminas presenta una hibridación sp3 y los sustituyentes se disponen hacia los tres vértices de un tetraedro, el cuarto vértice lo ocupa el par solitario.
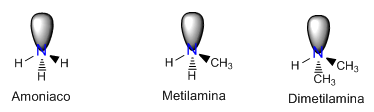
Quiralidad e inversión de las aminas
Cuando una amina tiene tres sustituyentes diferentes, el nitrógeno se convierte en quiral y la imagen especular no es superponible con la molécula. Sin embargo, las aminas son ópticamente inactivas debido a la inversión del nitrógeno, que interconvierte rápidamente los dos enantiómeros entre si, dando lugar a una mezcla racémica.
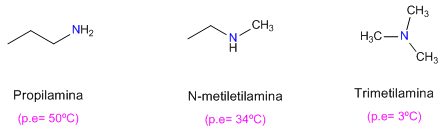
Puntos de fusión ebullición y solubilidad
Las aminas forman puentes de hidrógeno más débiles que lo alcoholes, debido a la menor polarización del enlace N-H frente al O-H. Por tanto, los puntos de ebullición de las aminas son más bajos y también presentan una menor solubilidad en agua.
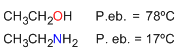
La menor electronegatividad del nitrógeno, comparada con la del oxígeno, hace que los puentes de hidrógeno que forman las aminas sean más débiles que los formados por los alcoholes.
También se observa que las aminas primarias tienen mayores puntos de ebullición que las secundarias y estas a su vez mayores que las terciarias.
YouTube | Miembros del canal Hazte miembro del canal para acceder a todos los vídeos Vídeos para miembros