 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp.
Más información en www.foroquimico.com
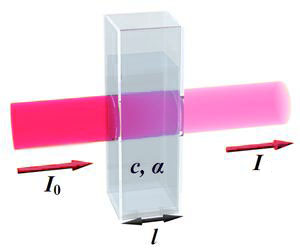 La Ley de Lambert-Beer introduce el concepto de absorbancia (A) de una muestra como $A=log\frac{I}{I_0}$. Donde $I_0$ representa la intensidad de la luz incidente e $I$ la intensidad de la luz que atraviesa la celda. También podemos expresar la absorbancia en función de la longitud de la cubeta y de la concentración de soluto.
La Ley de Lambert-Beer introduce el concepto de absorbancia (A) de una muestra como $A=log\frac{I}{I_0}$. Donde $I_0$ representa la intensidad de la luz incidente e $I$ la intensidad de la luz que atraviesa la celda. También podemos expresar la absorbancia en función de la longitud de la cubeta y de la concentración de soluto.\begin{equation} A=log\frac{I_0}{I}=\epsilon\cdot c\cdot l \end{equation}
Donde $l$ es la longitud de la cubeta en cm, $c$ representa la concentración de soluto en mol/l y $\epsilon$ es la absortividad molar (coeficiente de extinción molar) medido en l/mol.cm.
Para una concentración y una longitud de cubeta determinadas, la absortividad molar determina sí la intensidad de la banda (absorbancia) es alta o baja. Es muy habitual representar $log\epsilon$ en ordenadas en lugar de la absorbancia, en abscisas se representa la longitud de onda.
Para ver la importancia del coeficiente de absortividad molar, compararemos su valor en la transición $\pi \rightarrow\pi^{\ast}$ del 1,3-butadieno ($\lambda =217\;nm$), que presenta una $\epsilon =21000\;l/mol.cm$ ($log\epsilon=4,32$), con la transición $n\rightarrow \pi^{\ast}$ de la acetona ($\lambda =280\;nm$) la cual presenta $\epsilon =12\;l/mol.cm$ ($log\epsilon =1,08$).
En el caso del 1,3-butadieno se observa una banda intensa mientras que en la acetona corresponde a una banda de muy baja intensidad (transición prohibida). En general se consideran transiciones prohibidas las que tienen una absortividad molar inferior a 100 l/mol.cm.